La EMA rechaza aprobar la segunda terapia anti-amiloide para Alzheimer
Industria Farmacéutica naiarabrocal Vie, 28/03/2025 - 13:14 'Kisunla' El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) ha recomendado no aprobar la comercialización de Kisunla (donanemab), un anticuerpo monoclonal de administración mensual destinado al tratamiento de la enfermedad de Alzheimer en fases iniciales.El comité considera que los beneficios de este medicamento anti-amiloide no superan el riesgo de efectos adversos graves en el cerebro, potencialmente mortales.Donanemab es la segunda terapia que ha demostrado eficacia clínica en la ralentización del deterioro cognitivo de los pacientes con Alzheimer gracias a un mecanismo de acción consistente en reducir los depósitos cerebrales de la proteína beta amiloide.Riesgo de ARIAEl principal problema de seguridad con este tipo de tratamientos es la aparición de anomalías de imagen relacionada con el amiloide (ARIA), microhemorragias o inflamaciones localizadas que se detectan con escáneres cerebrales. Aunque la mayoría son asintomáticas y se resuelven por sí solas, pueden ser graves e incluso mortales,En el caso del ensayo clínico de fase III con donanemab frente a placebo en 1.736 pacientes, el 36,8% de los pacientes tratados con el biológico presentaron ARIA frente al 14,9% de los del placebo. Además, el 1,6% de los que recibieron el fármaco experimentaron ARIA graves, que resultaron en tres muertes. Primeros datos clínicos que sugieren que los anti-amiloide previenen el Alzheimer , Llega la segunda terapia modificadora del Alzheimer, con un régimen simplificado, Tras una reevaluación, la EMA aprueba 'Leqembi' para demencia leve por Alzheimer En un grupo más restringido de pacientes, no portadores de ninguna copia del gen ApoE4, vinculado a un incremento del riesgo de desarrollar Alzheimer El CHMP considera que el beneficio de donanemab no supera el riesgo de ARIA, pese a que Lilly solicitó un uso restringido en pacientes no portadores de copias de ApoE4. Off Naiara Brocal Empresas Empresas Neurología Farmacia Hospitalaria Farmacología Off

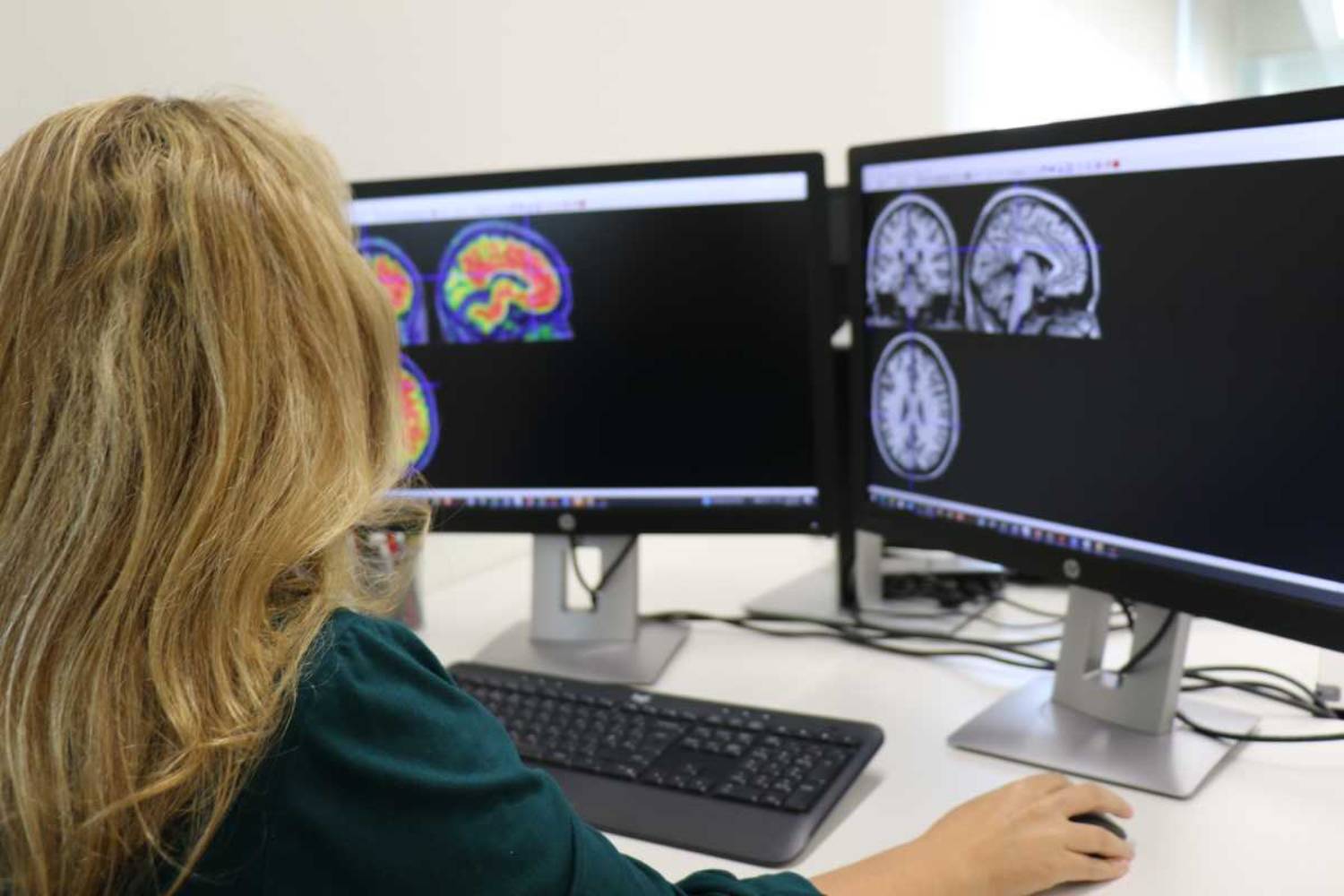
El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) ha recomendado no aprobar la comercialización de Kisunla (donanemab), un anticuerpo monoclonal de administración mensual destinado al tratamiento de la enfermedad de Alzheimer en fases iniciales.
El comité considera que los beneficios de este medicamento anti-amiloide no superan el riesgo de efectos adversos graves en el cerebro, potencialmente mortales.
Donanemab es la segunda terapia que ha demostrado eficacia clínica en la ralentización del deterioro cognitivo de los pacientes con Alzheimer gracias a un mecanismo de acción consistente en reducir los depósitos cerebrales de la proteína beta amiloide.
Riesgo de ARIA
El principal problema de seguridad con este tipo de tratamientos es la aparición de anomalías de imagen relacionada con el amiloide (ARIA), microhemorragias o inflamaciones localizadas que se detectan con escáneres cerebrales. Aunque la mayoría son asintomáticas y se resuelven por sí solas, pueden ser graves e incluso mortales,
En el caso del ensayo clínico de fase III con donanemab frente a placebo en 1.736 pacientes, el 36,8% de los pacientes tratados con el biológico presentaron ARIA frente al 14,9% de los del placebo. Además, el 1,6% de los que recibieron el fármaco experimentaron ARIA graves, que resultaron en tres muertes.