La France manque-t-elle d’attractivité en matière de recherche clinique ? Tirer parti des pratiques espagnoles
L’Espagne attire de plus en plus de laboratoires pour y réaliser la phase critique de leurs essais cliniques. Quelles leçons tirer du succès espagnol ? Comment la France peut-elle rester dans la course ?

L’Espagne attire de plus en plus de laboratoires pour y réaliser la phase critique de leurs essais cliniques. En quelques années, elle est même devenue le leader européen dans ce domaine. Quelles leçons tirer du succès espagnol ? La France peut-elle rester dans la course et par quels moyens ?
La recherche clinique est un passage obligé précédant la commercialisation d’un nouveau traitement. Longs, complexes et coûteux, les essais cliniques représentent un enjeu majeur pour les industriels qui doivent, de ce fait, choisir avec discernement les pays et les centres au sein desquels les essais seront menés dans chacun des pays retenus.
Depuis quelques années, l’Espagne gagne en attractivité. Comment peut faire la France pour tirer parti de l’exemple espagnol ? Y-a-t-il des leçons à apprendre de notre voisin ?
Pour un pays souhaitant être attractif dans le secteur pharmaceutique, il est essentiel d’être à la fois rapide et professionnel dans le domaine. Il en va de sa souveraineté en matière de politique de santé, de l’accès possible de ses nationaux à l’innovation thérapeutique, mais aussi de la compétitivité internationale d’un secteur, la santé, qui emploie 6,5 % de la population active française.
Un process pouvant durer 15 ans !
La mise sur le marché d’un nouveau traitement est un processus qui peut durer jusqu’à quinze ans. De la phase de recherche et développement (R&D) à l’autorisation de mise sur le marché (AMM), le parcours d’un lancement est ponctué de nombreuses étapes, dont les essais cliniques représentent le point le plus onéreux et le plus sensible. Ce terme désigne les études menées sur des patients et/ou des volontaires sains, afin de mettre en évidence certaines caractéristiques d’un traitement avant sa commercialisation.
À lire aussi : Industrie pharmaceutique : le secteur privé ne suffit plus à porter l’innovation
Quatre phases doivent être clairement différenciées en recherche clinique :
– La phase I permet d’évaluer la toxicité du médicament et sa tolérance chez l’humain. Elle est réalisée sur un petit groupe de patients (quelques dizaines) permettant de déterminer le dosage et la fréquence d’administration du nouveau traitement.
– La phase II, réalisée sur quelques centaines de patients, a pour objectif de montrer l’efficacité de la nouvelle molécule.
– La phase III évalue l’intérêt thérapeutique du nouveau traitement en le comparant au traitement de référence pour déterminer les améliorations qu’il apporte. Quelques centaines voire plusieurs milliers de patients sont alors inclus à ce stade.
– La phase IV, mise en place après la commercialisation du nouveau traitement, permet de suivre les effets de ce traitement à plus long terme. On parle alors d’essais de pharmacovigilance.
Pour pouvoir être commercialisé, le traitement doit avoir chronologiquement validé les phases I, II puis III. C’est un processus extrêmement long qui grève d’autant la protection brevetaire de 20 ans accordée à l’industriel ou au chercheur dans le domaine.
Du lundi au vendredi + le dimanche, recevez gratuitement les analyses et décryptages de nos experts pour un autre regard sur l’actualité. Abonnez-vous dès aujourd’hui !
Un vrai coût économique
Les essais cliniques peuvent représenter jusqu’à 90 % des investissements nécessaires au développement de nouveaux médicaments, comme l’ont montré plusieurs travaux.
D’autres sources estiment que la recherche clinique constitue environ les deux tiers des coûts totaux de développement – pour un montant généralement compris de 1 milliard à 2 milliards d’euros.
L’importance du coût induit pour le laboratoire est encore aggravée par la durée d’investissement requise pour mettre sur le marché un nouveau traitement ; durée au cours de laquelle l’industriel ne réalise aucun bénéfice. Valider chacune des phases le plus rapidement possible et rentabiliser ainsi les investissements et les années consacrées par l’industriel à la recherche représente, en l’espèce, un enjeu majeur pour les promoteurs d’essais cliniques. Les industriels vont ainsi fonder leurs préférences sur des comparatifs de compétitivité entre les pays envisagés dans le domaine et sur la qualité, la fiabilité et l’expérience acquise par chacun des centres au sein d’un pays donné.
Des atouts français existants mais limités
La France dispose de nombreux avantages qui font d’elle un pays attractif en matière de recherche clinique, dans les phases précoces et pour des aires thérapeutiques spécifiques – l’oncologie ou les maladies auto-immunes notamment.
Des innovations entrepreneuriales comme Klineo ou Accesstrial, grâce à leurs algorithmes, permettent d’identifier les essais cliniques pertinents pour chaque patient atteint de cancer. Ospi utilise les dernières avancées en matière de traitement naturel du langage pour intégrer en temps réel l’essentiel des données hospitalières structurées et textuelles et mettre ainsi l’intelligence artificielle à disposition de l’identification plus rapide de patients dans les essais cliniques. Par ailleurs, des mesures d’accompagnement public initiées par l’Agence de l’innovation en santé (AIS) ou le Crédit impôt recherche (CIR), permettent à la France de rester relativement compétitive en Europe.
Mais la concurrence européenne et mondiale menace son attractivité de façon continuelle et croissante.
Abonnez-vous dès aujourd’hui !
Chaque lundi, recevez gratuitement des informations utiles pour votre carrière et tout ce qui concerne la vie de l’entreprise (stratégie, RH marketing, finance…).
En regard de notre pays qui souffre de deux lacunes majeures au développement de la recherche clinique – un cadre réglementaire beaucoup trop pesant et une lenteur des procédures délétère qui tend même à s’allonger, l’Espagne a consolidé sa position de leader européen.
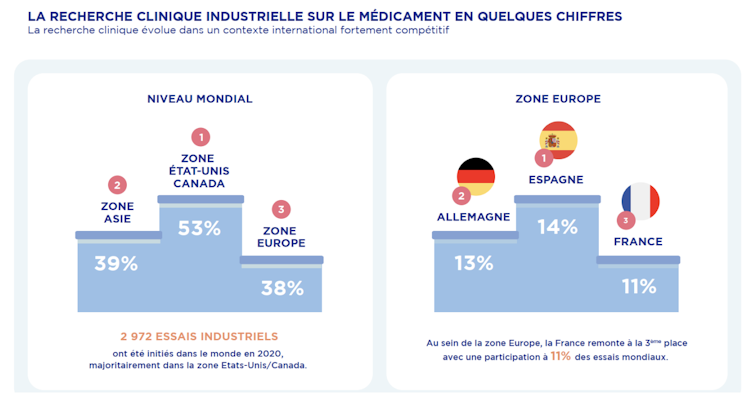
En réalisant plus de 850 essais cliniques entre 2014 et 2017, elle surpassait déjà l’Allemagne et la France. En 2020, l’Espagne a maintenu sa position en participant à 14 % des essais cliniques mondiaux, se plaçant de nouveau en tête des pays européens. Cette tendance s’est poursuivie en 2022, où l’Espagne a autorisé 924 essais cliniques, confirmant ainsi son rôle de leader en Europe.
Comparer les pratiques espagnoles et françaises apporte quelques éclairages sur des bonnes pratiques qui représentent autant de nouvelles initiatives et de voies d’amélioration possibles pour rendre à la France un leadership perdu depuis les années 2000 en matière de recherche clinique.
Une course contre le temps
L’attractivité de l’Espagne s’explique par plusieurs avantages compétitifs. Pour commencer, les délais d’autorisation y sont plus courts. Pour ce faire, l’Espagne a simplifié ses procédures réglementaires, permettant aux industriels d’initier un essai clinique et d’inclure un premier patient en seulement 149 jours.
En regard, et depuis le lancement du projet d’envergure France 2030, il y a quatre ans, 160 jours sont désormais nécessaires entre le dépôt d’autorisation d’ouverture d’essai à l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et l’intégration d’un premier patient dans les essais cliniques.
L’objectif de réduction de ces délais, essentiels nous l’avons dit, est encore loin d’être atteint et les marges de progression restent considérables – sur l’inclusion des patients tout particulièrement.
Des processus davantage centralisés
De façon paradoxale, pour un pays plus fédéral et décentralisé que la France dans ses principes d’organisation nationaux – en matière de santé notamment –, l’Espagne a mis en place une procédure unique et harmonisée à travers l’Agence espagnole des médicaments et produits de santé (AEMPS), réduisant ses pesanteurs administratives.
En comparaison, la multiplicité des instances françaises ralentit le processus et constitue un frein à l’attractivité de notre pays. Hôpitaux mis à part, l’ANSM édicte l’autorisation réglementaire nécessaire pour démarrer les essais, les comités de protection des personnes (CPP) évaluent la pertinence scientifique, la sécurité des participants et le respect des principes éthiques de l’essai concerné, la Commission nationale de l’informatique et des libertés (CNIL) est également mobilisée au cas où l’essai nécessite la collecte et le traitement de données personnelles sensibles, le Comité économique des produits de santé (CEPS) est chargé d’évaluer le coût et l’intérêt des médicaments pour en fixer le remboursement.
Un fort investissement public
Parallèlement, l’État espagnol investit activement dans la recherche clinique, grâce à des incitations fiscales attractives et à un soutien sans failles des partenariats public-privé. Ces dispositifs fiscaux (réductions d’impôts, bonification sur les cotisations sociales, déductions diverses en faveur de l’innovation technologique pouvant atteindre jusqu’à 59 % des dépenses éligibles) sont combinés à une infrastructure de recherche solide et à un soutien gouvernemental actif. Tout cela concourt à renforcer l’attractivité de l’Espagne pour les entreprises souhaitant développer des projets d’innovation thérapeutique et de recherche clinique.
Par ailleurs, l’Espagne a su développer des collaborations dynamiques entre l’industrie pharmaceutique, les institutions académiques et les hôpitaux. Ce travail en commun facilite l’adoption rapide de nouvelles thérapies.
Les initiatives dans le domaine s’organisent autour de centres de recherche intégrés facilitant le transfert des découvertes du laboratoire au lit du patient, d’unités conscrées aux essais cliniques au sein de certains hôpitaux accélérant l’accès à des traitements expérimentaux, ou encore de hubs régionaux d’innovation en santé, comme celui de la municipalité de Barcelone visant à faciliter le développement de nouvelles thérapies autour de la maladie d’Alzheimer ou le Navarra Health Cluster regroupant 54 entités engagées dans la santé, renforçant ainsi la recherche biomédicale de la région).
Cet article a été écrit avec Diane Resplandy-Bernard, VC Analyst et diplômée du Master of Science in Biopharmaceutical Management–ESCP Business School.![]()
Frédéric Jallat ne travaille pas, ne conseille pas, ne possède pas de parts, ne reçoit pas de fonds d'une organisation qui pourrait tirer profit de cet article, et n'a déclaré aucune autre affiliation que son organisme de recherche.












































/2025/03/21/080-hl-bberaud-2707752-67ddef05e1ee3173179803.jpg?#)
/2025/03/21/cafe-67ddc87d601b5530746465.png?#)
/2025/03/21/080-hl-nguyonnet-2682801-67ddcfba5e3bf897752803.jpg?#)