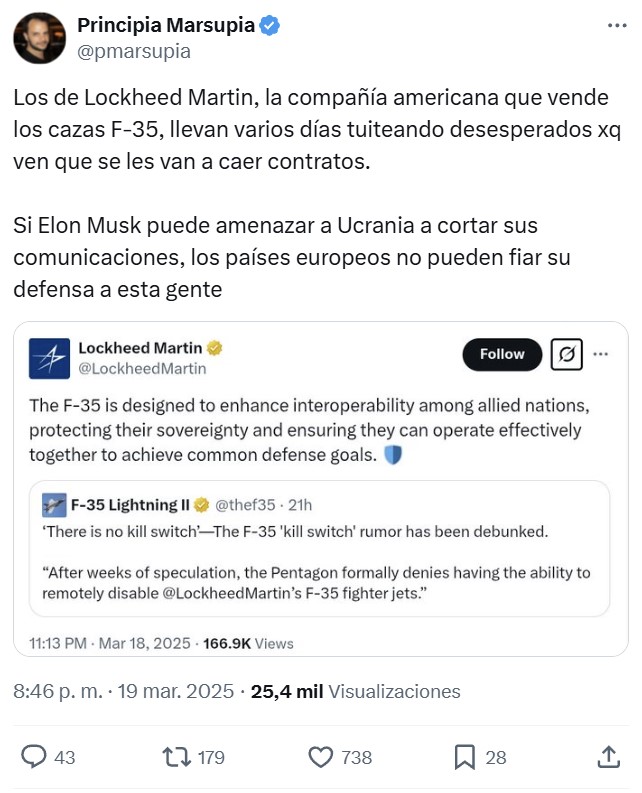
La Anmat modificó los requisitos para la aprobación de medicamentos de nueva generación
Se trata de los fármacos biosimilares de productos de referencia que se usan para tratar cánceres, enfermedades autoinmunes o diabetes; en el Gobierno argumentan que buscan incentivar la producción local de ese tipo de drogas y vacunas

La autoridad regulatoria nacional modificó los requisitos que deberán cumplir los laboratorios para demostrar que un medicamento biosimilar es comparable con el fármaco biológico de referencia. La nueva guía elaborada por la Administración Nacional de Alimentos, Medicamentos y Tecnología Médica (Anmat) publicó hoy en el Boletín Oficial.
En los últimos años, creció en el mundo la producción de medicamentos biológicos, que son los que se obtienen de organismos vivos que producen de manera controlada, en un laboratorio, el principio activo a utilizar (por ejemplo, una proteína). El proceso es más complejo y costoso que el del medicamento convencional o no biológico. Enfermedades autoinmunes, cáncer y diabetes son algunas de las aplicaciones que se les está dando en medicina.
“Estos medicamentos de origen biológico poseen una composición cualicuantitativa, una indicación terapéutica y una vía de administración que tienen antecedentes en otras especialidades medicinales autorizadas y registradas ante esta administración u otra agencia regulatoria de alta vigilancia sanitaria”, argumentaron desde la Anmat a través de un comunicado.
En tanto, desde el Ministerio de Salud señalaron que la llegada de biosimilares a la Argentina “fomenta la innovación y la eficiencia” en línea con la desregulación que impulsa la Casa Rosada. Agregaron sobre la nueva Guía de Comparabilidad para la aprobación de un biosimilar en el país: “Al reducir barreras y permitir que más actores privados ingresen a esta plaza, se impulsará una mayor competencia entre los proveedores. Esto reflejará una expansión en la oferta privada de productos impulsando la libertad de mercado, promoviendo el acceso a tratamientos más eficaces”.
Informaron, a la vez, que el déficit comercial de biológicos, sin incluir las vacunas, “ronda los US$ 700 millones” y que, al fomentar la producción local de biosimilares, el país “podrá reducir esta brecha, al mejorar su competitividad y su autonomía económica”.
La nueva disposición de la Anmat modifica los términos de la Disposición N° 7729 de 2011 que reguló las exigencias para la acreditación de la calidad, la eficacia y la seguridad al momento de registrar medicamentos similares a los biológicos para la aprobación de su comercialización en el país.
Consulta pública
La guía “Requerimientos, Lineamientos y Criterios para el Ejercicio de Comparabilidad de Especialidades Medicinales Biosimilares” se definió en la Anmat luego de una consulta pública, en la que profesionales y entidades que nuclean a laboratorios interesados, como la Cámara Argentina de Especialidades Medicinales (Caeme), comentaron sobre el borrador y señalaron potenciales debilidades asociadas con la complejidad del proceso de evaluación del biosimilar para acreditar que es comparable a el producto de referencia.
“La aprobación de biosimilares hasta esta modificación requería dentro del ejercicio de comparabilidad la realización de un estudio clínico de eficacia, pero no en todos los casos”, plantearon desde Salud.
“La eficacia de ese procedimiento se está relativizando en la medida en que las herramientas analíticas son de cada vez de más alto rendimiento, por lo que el ejercicio de comparabilidad requiere de pruebas cuidadosamente seleccionadas. Con un ensayo fármacocinético [cómo el organismo procesa el medicamento] o uno fármacodinámico [cómo el medicamento actúa en el organismo], se puede contar con la certeza de que es un medicamento biosimilar”, refirieron sobre uno de los puntos más sensibles para la regulación de esos productos.
La primera de las entidades en expresarse fue la Cámara Industrial de Laboratorios Farmacéuticos Argentinos (CILFA). A través de un comunicado, consideró en nombre de sus representados que la guía publicada por la Anmat es “un avance” que promueve la inversión y el desarrollo local de estas moléculas.
“Históricamente, contamos con distintos hitos tecnológicos como la producción de la insulina humana, eritropoyetina recombinante, hormona de crecimiento y otros biológicos —repasaron—. En 1984, nuestro último Premio Nobel en ciencias desarrolló la tecnología de hibridoma, que permite la producción de anticuerpos monoclonales, produciendo una revolución médica que beneficia a cientos de miles de pacientes en múltiples patologías. Desde hace más de 30 años, también producimos biosimilares y el mejor ejemplo son las actividades que llevan adelante empresas como BioSidus, Cassará, Elea, Mabxcience, Richmond, Amega Biotech y Denver Farma. Todas estas empresas producen medicamentos de alta calidad que son utilizados ampliamente en nuestro país y en otros mercados”.
Los requisitos
En las 31 páginas de la guía se define que un fármaco biosimilar que se quiera registrar en el país para su comercialización debe contar con el producto de referencia aprobado. A la vez, tendrá que reunir las siguientes características detalladas por la agencia regulatoria local:
- La posología (dosis, frecuencia y duración de uso) y la vía de administración deberán ser las mismas para el biosimilar que para el fármaco de referencia.
- Las indicaciones de uso del medicamento para el que se solicita la autorización a la Anmat deberá coincidir con las aprobadas para el de referencia
- El ingrediente activo del biosimilar debe ser similar (molecular y biológicamente) al del fármaco de referencia.
- Cualquier diferencia en cuanto a concentración, forma farmacéutica, formulación, excipientes o presentación requieren justificación científica e información adicional y eso no debe comprometer la seguridad del producto.
- Los cambios para mejorar la eficacia con respecto del fármaco de referencia no son compatibles con el enfoque de biosimilitud y el producto a registrar no reúne las características para ser considerado un biosimilar. “No obstante, las diferencias en cuanto a ventajas en seguridad podrían ser aceptables”, precisa la Anmat.
- Un fármaco de referencia puede tener más de una indicación terapéutica. Si un biosimilar demuestra ser comparable en una de sus indicaciones, para la Anmat “la extrapolación de los datos clínicos a otras indicaciones del PR podría ser aceptable, pero debe justificarse científicamente. Sin embargo, si no es claro si la seguridad y eficacia comprobadas en una indicación son aplicables a otra, será necesario aportar datos adicionales”.
- “Los estudios de estabilidad en tiempo real determinarán las condiciones de conservación y vida útil del biosimilar, que puede o no ser la misma” que para el fármaco de referencia. Esos estudios para el ingrediente activo deben hacerse con envases y en condiciones de uso real.






















-U47573153646yFg-1024x512@diario_abc.jpg)