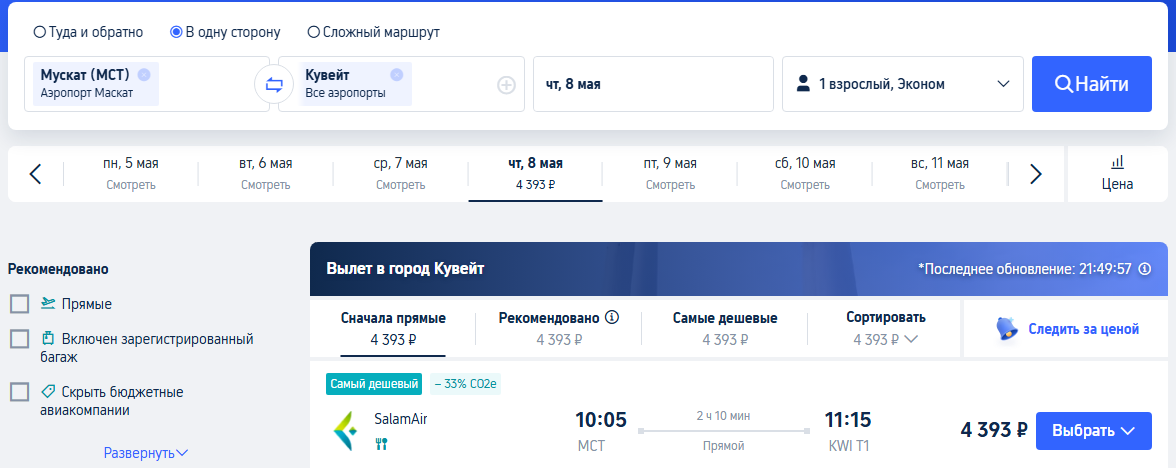
Biocad подала документы на регистрацию терапии гемофилии В
Компания Biocad направила в российский Минздрав документы на регистрацию первого в стране оригинального генотерапевтического препарата для лечения гемофилии В. Российская биотехнологическая компания Biocad подала документы в Минздрав для регистрации первой в России оригинальной разработки для генной терапии гемофилии В, передает ТАСС.Компания вложила более 3 млрд рублей в разработку и исследования препарата. Работа над проектом велась более семи лет. Препарат, получивший международное непатентованное наименование арвенакоген санпарвовек, предназначен для однократного введения. Регистрационное досье основывается на данных клинического исследования I–II фаз, в котором участвовали более двадцати мужчин с тяжелой формой гемофилии В. Заместитель гендиректора по клинической разработке и исследованиям Biocad Юлия Линькова подчеркнула, что после получения регистрационного удостоверения препарат станет доступен пациентам через один-три года. Наблюдение за участниками клинических исследований продолжится минимум пять лет, а также будет осуществляться набор новых участников для III фазы испытаний.Ранее девятый арбитражный суд подтвердил создание в России лекарства от рака без аналогов.

Российская биотехнологическая компания Biocad подала документы в Минздрав для регистрации первой в России оригинальной разработки для генной терапии гемофилии В, передает ТАСС.
Компания вложила более 3 млрд рублей в разработку и исследования препарата. Работа над проектом велась более семи лет.
Препарат, получивший международное непатентованное наименование арвенакоген санпарвовек, предназначен для однократного введения.
Регистрационное досье основывается на данных клинического исследования I–II фаз, в котором участвовали более двадцати мужчин с тяжелой формой гемофилии В.
Заместитель гендиректора по клинической разработке и исследованиям Biocad Юлия Линькова подчеркнула, что после получения регистрационного удостоверения препарат станет доступен пациентам через один-три года.
Наблюдение за участниками клинических исследований продолжится минимум пять лет, а также будет осуществляться набор новых участников для III фазы испытаний.
Ранее девятый арбитражный суд подтвердил создание в России лекарства от рака без аналогов.